原電池和電解池有什么區(qū)別?
一,、什么是原電池?
原電池primarybattery?種將活性物質(zhì)中化學(xué)能通過氧化還原反應(yīng)直接轉(zhuǎn)換成電能輸出的裝置。?稱化學(xué)電池,。由于各種型號(hào)的原電池氧原電池
化還原反應(yīng)的可逆性很差,,放完電后,不能重復(fù)使?,,故?稱?次電池,。它通常由正電極、負(fù)電極,、電解質(zhì),、隔離物和殼體構(gòu)成,可制成各種形狀和不同尺?,,使??便,。?泛?于?農(nóng)業(yè)、國防?業(yè)和通信,、照明,、醫(yī)療等部門,并成為?常?活中收?機(jī),、錄?機(jī),、照相機(jī)、計(jì)算器,、電?表,、玩具、助聽器等常?電器的電源,。原電池?般按負(fù)極活性物質(zhì)(如鋅,、鎘、鎂,、鋰等)和正極活性物質(zhì)(如錳,、汞,、?氧化硫、氟化碳等)分為鋅錳電池,、鋅空?電池,、鋅銀電池、鋅汞電池,、鎂錳電池,、鋰氟化碳電池、鋰?氧化硫電池等,。鋅錳電池產(chǎn)量最?,,常按電解質(zhì)分為氯化銨型和氯化鋅型,并按其隔離層分為糊式電池和低極電池,。以氫氧化鉀為電解質(zhì)的鋅錳電池,,由于其負(fù)極(鋅)的構(gòu)造與其他鋅錳電池不同?習(xí)慣上另作?類,稱為堿性鋅錳電池,,簡稱堿錳電池,,俗稱堿性電池。
原電池是?類使化學(xué)能直接轉(zhuǎn)換成電能的換能裝置,。原電池連續(xù)放電或間歇放電后不能以反向電流充電的?法使兩電極的活性物質(zhì)回復(fù)到初始狀態(tài),,電池基本都是化學(xué)能轉(zhuǎn)化為電能。所以你能看到的電池基本都屬于原電池的范疇,。如日常見到的鎳氫電池,、鋰聚合物電池等。
二,、什么是電解池?
1,、使電流通過電解質(zhì)溶液或熔融的電解質(zhì)?在陰、陽兩極上引起還原氧化反應(yīng)的過程叫做電解,。
2,、把電能轉(zhuǎn)變?yōu)榛瘜W(xué)能的裝置叫做電解池或電解槽。
3,、當(dāng)離子到達(dá)電極時(shí),,失去或獲得電子,,發(fā)生氧化還原反應(yīng)的過程電解原理(電解池裝置如圖)
陰極:與電源負(fù)極相連的電極,。(得電子發(fā)生還原反應(yīng))
陽極:與電源正極相連的電極。(失電子發(fā)生氧化反應(yīng))
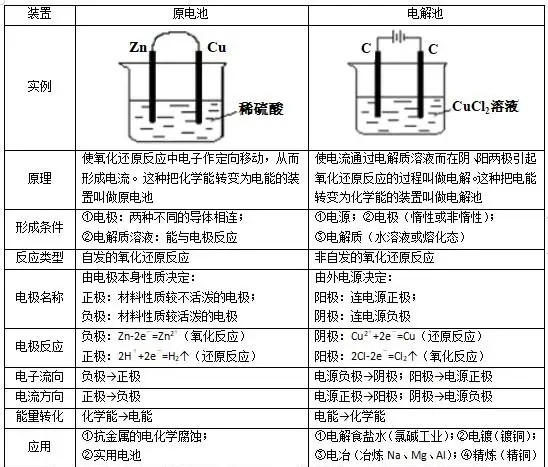
三,、原電池與電解池有什么區(qū)別?
1,、電解池與原電池的本質(zhì)差別本質(zhì)差別電解池把電能轉(zhuǎn)化為化學(xué)能,原電池把化學(xué)能轉(zhuǎn)化為電能,。
2,、電解池本身要有外加電源才能發(fā)揮用途,,而原電池不要外接電源就可以正常供電。
3,、電解池和原電池的電子流向是不相同的,。原電池的流向跟電流的方向呈相反反向(電流正電荷流向,電子帶負(fù)電);而電解池跟原電池相反(電子經(jīng)負(fù)極流出到電解池中),。
4,、原電池的應(yīng)用一般是在蓄電池上面,而電解池一般是應(yīng)用在電鍍,、精煉,、冶金等工業(yè)方面。
5,、電解池的一般沒有正負(fù)極區(qū)分,,一般都是叫陰陽極,而原電池就是我們熟悉的正負(fù)極區(qū)分,。
6,、原電池和電解池電的區(qū)別|:原電池是對(duì)外供電的,是自發(fā)的,,而電解池需要通電,,是被動(dòng)的。
相關(guān)文章
-

芯聯(lián)新 | 深圳格瑞普2025年會(huì)盛典圓滿舉辦
2025-01-15 -

液態(tài)鋰電池與固態(tài)鋰電池:究竟誰能驅(qū)動(dòng)電池技術(shù)的未來,?
2025-01-03 -
智能眼鏡電池全解析,智能眼鏡電池廠家教你怎么選
2024-12-17